| Dissertation |
|
|
|
|
|
|
3. Ergebnisse |
. | ||||||||||||||||||||||||||||||||||||||||
|
3.1. FLADOP beim Augengesunden |
Bei der
Betrachtung der FLADOP ist man zunächst beeindruckt von der Dynamik
der Füllung im retinalen und choroidalen Gefäßbett.
Durch den verzögerten Einstrom des Fluoreszeins sind die verschiedenen Gefäßabschnitte der Aderhaut zu erkennen. So kann die Füllung der großen Aderhautgefäße unmittelbar nach ihren Skleradurchtritt bis hin zu den Aderhautlobuli verfolgt werden. Auffallend ist auch eine große interindividuelle Variabilität in Lage, Größe und Form der einzelnen Aderhautsegmente. Sie findet ihren Ausdruck in unterschiedlichen choroidalen Füllungsmustern. Trotz dieser Variabilität lassen sich die Beobachtungen, die während der FLADOP gemacht werden können, in verschiedene zeitlich und räumlich differenzierbare Füllungsphasen einteilen. Diese Füllungsphasen sind konstant in jeder FLADOP nachweisbar. |
||||||||||||||||||||||||||||||||||||||||
|
3.1.1. Phase der retinalen arteriellen Pulsation |
Nach Injektion
des Fluoreszeins und Erhöhung des intraokularen Drucks auf suprasystolische
Werte sistiert jegliche intraokulare Perfusion. Noch vor dem Einleiten der
Drucksenkungsphase ist deutlich eine Fluoreszenzzunahme in der Papille zu
erkennen. Sie kommt durch eine Anreicherung des Fluoreszeins in den retrolaminären
Gefäßen zustande (Abb. 10)
. Bei Unterschreiten des systolischen Blutdrucks der Zentralarterie öffnet sich dieselbe im Bereich der Lamina cribrosa. Das Fluoreszein breitet sich nun pulsierend in den retinalen Arteriolen aus. Gelegentlich läßt sich beobachten, daß das in der Systole einströmende Fluoreszein während der Diastole wieder zurückgepreßt wird. Erst bei weiter absinkendem intraokularen Druck wird dann ein Voranschreiten der Farbstoff-Front sichtbar. Da durch den weiterhin erhöhten intraokularen Druck der Einstrom von Fluoreszein in die Choriokapillaris verhindert wird, wird das retinale Kapillarbett besonders kontrastreich dargestellt (Abb. 11) . Das retinale Kapillarbett füllt sich nicht gleichmäßig. Zunächst öffnen sich die Netzhautkapillaren der peripapillären Region. Erst bei weiterem Absinken des intraokularen Drucks werden die Kapillarnetze der perimakulären Region und der Netzhautperipherie perfundiert. Gelegentlich erkennt man, daß benachbarte Kapillarnetze der Netzhaut, die den gleichen Abstand zur Papille haben, sich nicht gleichzeitig, das heißt bei gleichem intraokularen Druck öffnen. Vor allem peripapillär lassen sich solche nebeneinander liegende Kapillarabschnitte mit unterschiedlichem Füllungsverhalten nachweisen. |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 10 retrolaminäre Fluoreszenz bei suprasystolischen Drucken (FLADOP, IOD = 107 mmHg) |
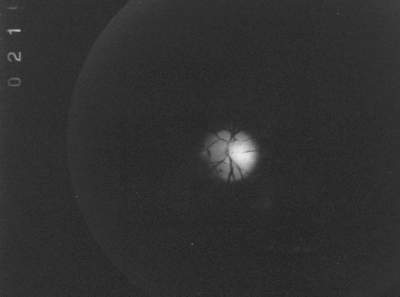
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 11 Phase der retinalen arteriellen Pulsationen (FLADOP, IOD = 93 mmHg) |
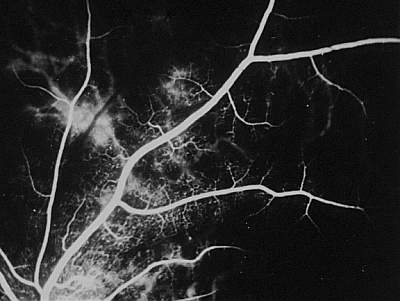
|
||||||||||||||||||||||||||||||||||||||||
|
3.1.2. Phase der Füllung der großen Aderhautgefäße |
Im konventionellen
Fluoreszenzangiogramm kommen die großen Aderhautgefäße in
der Regel nicht zur Darstellung. Durch den besonders großen Blutfluß
in der Aderhaut vollzieht sich die Füllung der tieferliegenden Aderhautgefäße
beinahe simultan mit der Füllung der Choriokapillaris. Demgegenüber
kann mit Hilfe der FLADOP der Einstrom des Fluoreszeins in die Aderhaut um
ein vielfaches zeitlich gestreckt werden.
Entsprechend der Anatomie der Aderhaut füllen sich bei hohen intraokularen Drucken zunächst nur die großen Aderhautgefäße der Haller'schen Schicht. Die Reihenfolge der Füllung dieser Gefäße ist von einer außerordentlichen Variabilität. Am häufigsten findet man die frühe Anfärbung von großen Aderhautgefäßen in der peripapillären Region. Die kurzen hinteren Ziliararterien scheinen hier in unmittelbarer Nachbarschaft zur Papille die Sklera zu durchdringen. Auf ihrem sternförmigen Verlauf zur Peripherie verzweigen sie sich mehrmals auf dichotome oder asymmetrische Art. Wie in Abb. 12 zu erkennen ist, stellt sich gelegentlich eine ringförmige arterielle Anastomose um die Papille dar. Sie entspricht dem Zinn-Haller'schen Gefäßring. Unter der weiteren Abnahme des intraokularen Drucks treten nun weitere große Aderhautgefäße an unterschiedlichen Stellen des hinteren Pols in Erscheinung. Ihre langsame Füllung mit Fluoreszein erlaubt den Durchtritt durch die Sklera sowie den weiteren Gefäßverlauf genau zu lokalisieren. Die frühe peripapilläre Füllung der Haller'schen Gefäßschicht ist jedoch nicht obligat. Ebenso kann beobachtet werden, daß sich zunächst verschiedene Gefäßstämme in der mittleren Peripherie anfärben, während sich die peripapillären Gefäße mit Verzögerung füllen (Abb. 13) . |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 12 Phase der Füllung der großen Aderhautgefäße Zinn-Haller'scher Gefäßring mit abzweigenden Arteriolen (FLADOP, IOD = 75 mmHg) |
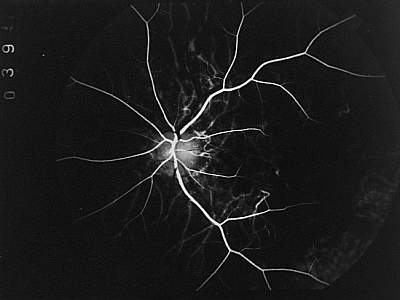
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 13 Phase der Füllung der großen Aderhautgefäße (FLADOP, IOD = 68 mmHg) |
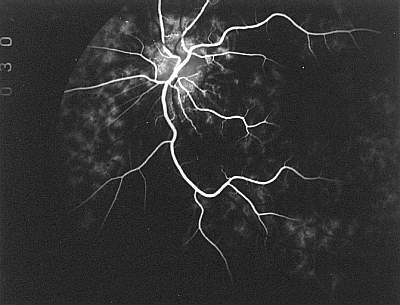
|
||||||||||||||||||||||||||||||||||||||||
|
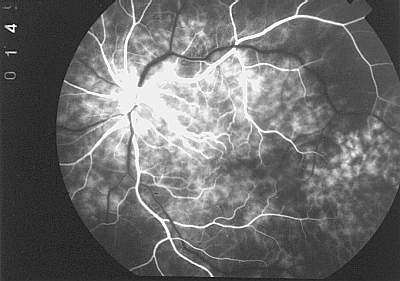
3.1.3. Phase der lobulären Füllung der Aderhaut |
Ausgehend
von den großen Gefäßen der Haller'schen Schicht erreicht
das Fluoreszein bei weiterem Druckausgleich die nachfolgenden Gefäßabschnitte
der Aderhaut. So entspringt aus Ästen der großen Aderhautgefäße
ein kleines Gefäßnetz, das in direkter Beziehung zu den sich später
füllenden Aderhautlobuli steht. Anhand des Füllungsmusters dieses
Gefäßnetzes läßt sich vermuten, daß es sich hierbei
um die Gefäße der Sattler'schen Schicht und der Choriokapillaris
handelt. An verschiedenen Stellen des hinteren Pols, häufig in der Nähe der zuerst füllenden großen Aderhautgefäße, kommen nun die ersten Aderhautlobuli der Choriokapillaris zur Darstellung. Sie sind zunächst noch durch einen kleinen hypofluoreszenten Saum deutlich voneinander abgrenzbar. Mit der weiteren Normalisierung des intraokularen Drucks treten weitere angrenzende Aderhautlobuli hinzu und verschmelzen zu den einzelnen Aderhautsegmenten. Im Verlauf der lobulären Füllungsphase stellt sich die Anfärbung der Aderhautsegmente wie folgt dar (Abb. 14) : Im Zentrum der Aderhautsegmente sind die Aderhautlobuli bereits vollständig gefüllt und nicht mehr voneinander abgrenzbar. Die Aderhautfluoreszenz ist in diesem Gebiet homogen. Im Randbereich der Segmente finden sich noch voneinander abgrenzbare Aderhautlobuli beziehungsweise Lobuli, die gerade erst eine kleine zentrale Fluoreszenz zeigen . Auch können hier gelegenlich noch kleinere Aderhautgefäße erkannt werden. Zwischen den einzelnen Aderhautsegmenten liegen bandförmige hypofluoreszente Areale, die sich erst im weiteren Verlauf der FLADOP lobulär füllen werden. Sie bilden die Grenzen der Aderhautsegmente und markieren somit die Trennlinien zwischen unabhängigen Endstromgebieten der Aderhaut. Sie sind identisch mit den von Hayreh beschriebenen ' Wasserscheiden ' ('Watershetzones', Hayreh 1983a, 1990) Lage, Größe und Form der Aderhautsegmente und der Verlauf der Wasserscheiden haben eine hohe Variabilität. Fast regelmäßig erkennt man eine senkrechte Wasserscheide, die in der Nähe der Papille oder Makula verläuft und den Fundus in eine mediale und temporale Hemisphäre teilt. In der temporale Hemisphäre selbst können sich mehrere, manchmal bis zu 5, Aderhautsegmente darstellen. Anhand der Ausdehnung der Aderhautsegmente und der Lage der Wasserscheiden können die FLADOP's verschiedenen Füllungstypen zugeordnet werden (s.u.). |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 14 lobuläre Fülllungsphase (FLADOP, IOD = 69 mmHg) |
|
||||||||||||||||||||||||||||||||||||||||
|
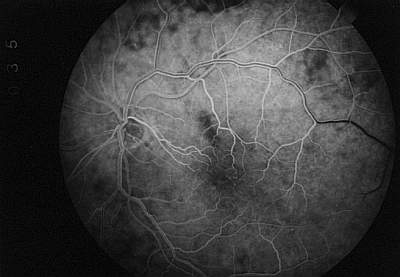
3.1.4. Phase der diffusen Aderhautfüllung |
Mit der
weiteren Normalisierung des intraokularen Drucks kann das Fluoreszein die
fenestrierten Sinusoiden der Choriokapillaris verlassen. Die interstitielle
Ansammlung des Fluoreszeins in der Choriokapillaris verdeckt alle Gefäßstrukturen
der Aderhaut. Diese Phase ist bei der normalen Angiographie ca. 0,3 Sekunden
nach Auftreten der ersten Aderhautfluoreszenz erreicht, sie wird aber bei
der FLADOP durch den langsamen Druckausgleich um den Faktor 80 bis 100 verzögert.
Hierin liegt der besondere Wert der FLADOP für die Darstellung der tieferliegenden
Gefäßabschnitte der Aderhaut.
Die Spätphase der Aderhautfluoreszenz unterscheidet sich nicht mehr von der normalen Fluoreszenzangiographie. In der diffusen Färbung der Choriokapillaris stellen sich die jetzt fluoreszeinfreien Aderhautgefäße als unscharfe, dunkel Streifen dar (Negativ-Darstellung der Aderhautgefäße). Fluoreszenzangiographische Befunde, wie z.B. pathologische Hyperfluoreszenzen oder Fensterdefekte, können genauso wie bei der konventionellen Angiographie erhoben werden (Abb. 15) . |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 15 Phase der diffusen Aderhautfüllung (FLADOP, IOD = 45 mmHg) |
|
||||||||||||||||||||||||||||||||||||||||
|
3.2. FLADOP und digitale Bildverarbeitung |
Durch
die Angiographie unter absinkendem intraokularen Druck wird bereits durch
die zeitliche Trennung der Fluoreszenz der großen Aderhautgefäße
in der Haller' schen und Sattler'schen Schicht und der diffusen Fluoreszenz
der Choriokapillaris eine detaillierte Analyse der Vaskularisation der Aderhaut
ermöglicht. Um eine weitere Verbesserung der Abbildung dieser Strukturen zu erreichen, haben wir 5 FLADOP's mit dem digitalen Funduskamera-System DFC-512 (Ophthalmic Imaging Systems, OIS) aufgezeichnet, und einer digitalen Bildverarbeitung unterworfen. |
||||||||||||||||||||||||||||||||||||||||
|
3.2.1. Orginalbild |
Unmittelbar nachdem die Aufnahme der FLADOP abgeschlossen ist, können die einzelnen Bilder des Angiogramms einer digitalen Bildverarbeitung zugeführt werden (Abb. 16) . Die Netzhautgefäße werden, soweit keine Trübungen der brechenden Medien vorliegen, angiographisch stets kontrastreich abgebildet. Da die Fluoreszenz der Aderhautgefäße durch die darüberliegenden Strukturen (Netzhaut mit Pigmentepithel und Choriokapillaris) sowohl absorbiert als auch gestreut wird, kommen diese nur unscharf zur Darstellung. | ||||||||||||||||||||||||||||||||||||||||
|
Abb. 16 Digitales Funduskamera-System DFC-512 (DFC-FLADOP): Darstellung des gesamten Angiogramms in 2 Sets von jeweils 16 Bildern
|
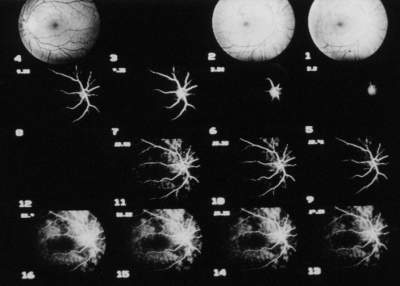
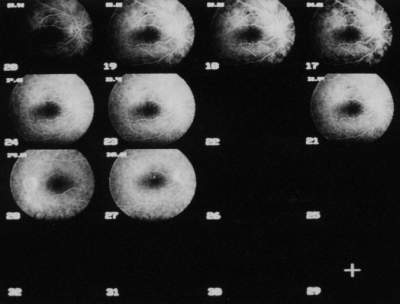
|
||||||||||||||||||||||||||||||||||||||||
|
3.2.2. Image Sharpening (Bildschärfung) |
Mit 'Image
Sharpening' steht eine Funktion zur Verfügung, mit der ein Teil dieser
Unschärfe korrigiert werden kann. Hierzu werden die Grauwerte der einzelnen
Bildpunkte (Pixel) erfaßt und dahingehend in ihrem Wert verändert,
daß Konturen (Kontraste) akzentuiert dargestellt werden. Für die
Bearbeitung der Angiogramme haben wir als ersten Schritt stets diese Funktion
für das gesamte Bild angewandt.
Wie in Abbildung 17 zu sehen ist, besteht aber auch die Möglichkeit nur kleinere Bildausschnitte zu bearbeiten. Hier erkennt man die Auswirkung dieser Funktion auf die Wiedergabe größerer Aderhautgefäße. Die Gefäße treten nach der Bearbeitung wesentlich deutlicher in Erscheinung. Selbst kleinere Gefäßäste, die zuvor nicht zu erkennen waren, werden nun sichtbar. In der späteren lobulären Füllungsphase können die Größe der Aderhautsegmente und der Lage der Wasserscheiden durch die Bildschärfung leichter bestimmt werden. |
||||||||||||||||||||||||||||||||||||||||
|
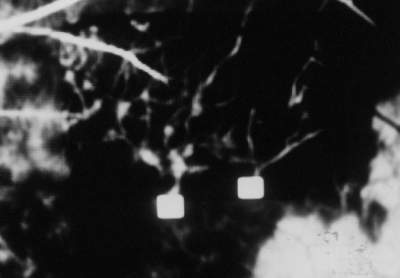
Abb. 17 Digitales Funduskamera-System (DFC-FLADOP, IOD = 78 mmHg) oben : Orginalbild unten : Image Sharpening Quadrat = Durchtrittsstelle der Aderhautgefäße |
|
||||||||||||||||||||||||||||||||||||||||
|
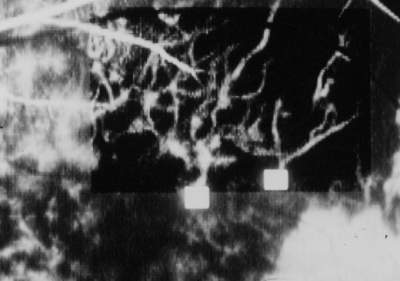
Abb. 18 Digitales Funduskamera-System DFC-512 Image processing |
|
||||||||||||||||||||||||||||||||||||||||
|
3.2.3. Contrast Enhancement |
Jedem
Bildpunkt (Pixel) der ursprünglichen digitalen Aufnahme ist ein Grauwert
zugeordnet. Die Grauwerte aller Bildpunkte sind Teil eines Spektrums, das
mit der Funktion 'Contrast Enhancement' (Kontrastverstärkung) verändert
werden kann. Durch Verschiebung des Grauwertspektrums kann das Bild in seiner
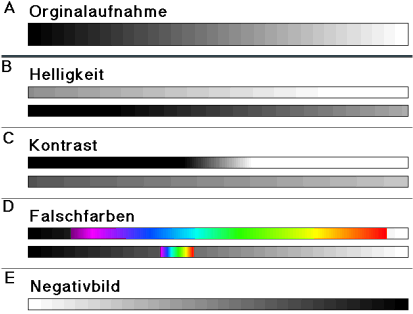
Gesamthelligkeit reguliert werden (Abb. 18-B)
. Durch Stauchung bzw. Streckung des Grauwertspektrums wird der Kontrast
der Aufnahme verändert (Abb. 18-C)
. Vor allem in den frühen Phasen der FLADOP ist die Anpassung von Kontrast- und Helligkeitswerten von großem Vorteil. Der erste Einstrom des Fluoreszeins in die Aderhaut ist sehr diskret und auf der ursprünglichen Aufnahme kaum zu erkennen (Abb. 19) . Nach der Bearbeitung mit 'Contrast Enhancement' wird es möglich die skleralen Durchtrittsstellen der Ziliargefäße sichtbar zu machen. Wie sich die Darstellung der Füllung einzelner Aderhautlobuli durch Kontrast- und Helligkeitsanpassung verbessern läßt, wird in Abb. 20 demonstriert. In diesen Aufnahmen findet sich im peripapillären Gebiet eine bereits fortgeschrittene lobuläre Füllung. Zunächst haben wir mit der Funktion Contrast Enhancement das gesamte Bild so eingestellt, daß sich diese peripapilläre Fluoreszenz optimal darstellt. In einem weiteren Schritt wurde der Bildausschnitt temporal der Makula ausgewählt und einer weiteren Bearbeitung unterzogen. Dadurch wird es möglich, mehrere Aderhautgebiete von völlig unterschiedlicher Fluoreszenz auf ein und derselben Abbildung in optimierter Weise zur Darstellung zu bringen. Auch zeigt sich, wie die Qualität der fluoreszenzangiographischen Wiedergabe choroidaler Strukturen durch die Anwendung digitaler Bildverarbeitungsprozesse verbessert werden kann. |
||||||||||||||||||||||||||||||||||||||||
|
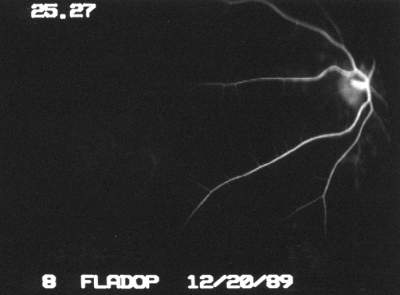
Abb.19 Digitales Funduskamera-System (DFC-FLADOP, IOD = 80 mmHg) oben : Orginalbild unten : Contrast Enhancement |
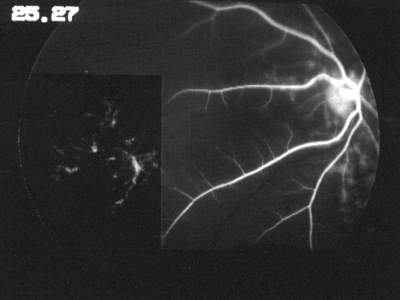
|
||||||||||||||||||||||||||||||||||||||||
|
Abb.20 Digitales Funduskamera-System (DFC-FLADOP, IOD = 69 mmHg) oben : Orginalbild unten : Contrast Enhancement |
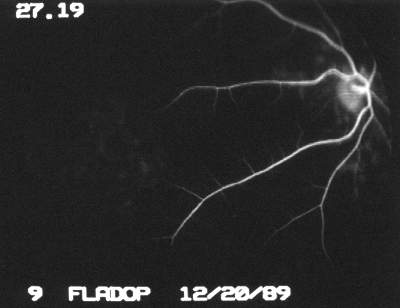
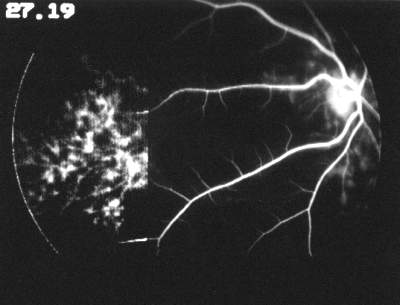
|
||||||||||||||||||||||||||||||||||||||||
|
3.2.4. Zoom |
In das
Bildverarbeitungssystem der DFC-512 ist ein digitaler Zoom mit vier verschiedenen
Vergrößerungsstufen integriert. Insbesondere bei der Analyse der
Füllungsvorgänge auf dem Niveau der Aderhautlobuli haben wir diese
Funktion genutzt. Abb. 21ad zeigt die Füllung eines temporalen Aderhautsegments. Zunächst sind nur die großen Aderhautgefäße mit Fluoreszein gefüllt. Wie in diesem Beispiel kann man sehr häufig erkennen, daß sich innerhalb eines Segments mehrere Aderhautgefäße unabhängig voneinander anfärben. In der Frühphase der FLADOP (Abb 21ab) erkennt man, wo die skleralen Durchtrittsstellen der Aderhautgefäße lokalisiert sind. Bei Reduktion des intraokularen Drucks füllen sich auch die kleineren Gefäßäste mit Fluoreszein. Sie treten als fächerförmige Verzweigungen in Erscheinung, die sich nach allen Seiten ausbreiten. Die lobuläre Füllungsphase beginnt im Zentrum des Aderhautsegments (Abb 21cd) . Vergleicht man die frühe Füllung der großen Aderhautgefäße mit dem Erscheinen der ersten Aderhautlobuli, so stellt man fest, daß die erste lobuläre Fluoreszenz häufig in der Nachbarschaft der großen Aderhautgefäße zu finden ist. Die Ausbreitung der lobulären Füllung folgt in der Regel den gleichen Weg wie das Voranschreiten des Farbstoffs in den Aderhautgefäßen. Die erste Anfärbung eines Aderhautlobulus besteht zunächst aus einer kleinen zuweilen punktförmigen Fluoreszenz, die einer zentralen Arteriole entspricht. Besonders in den Ausschnittvergrößerungen (Abb 21cd) erkennt man, wie bei Absinken des Augeninnendrucks diese Fluoreszenz an Größe zunimmt. Bei einem bestimmten intraokularen Druck haben diese Flecken ihre maximale Ausdehnung erreicht, sind aber noch immer durch einen schmalen, hypofluoreszenten Saum voneinander abgrenzbar. Erst mit dem Austritt des Fluoreszeins in das Interstitium entsteht die homogene Anfärbung der Choriokapillaris. |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 21ab Digitales Funduskamera-System (DFC-FLADOP, IOD = a: 81 mmHg b: 74 mmHg) Zoom |
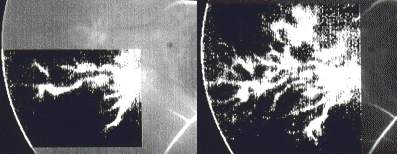
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 21cd Digitales Funduskamera-System (DFC-FLADOP, IOD = c: 65 mmHg d: 50 mmHg) Zoom |
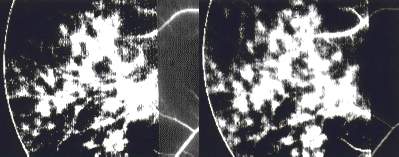
|
||||||||||||||||||||||||||||||||||||||||
|
3.2.5. Pseudocolor (Falschfarben) |
Eine weitere
Möglichkeit der digitalen Bildverarbeitung ist die Einfärbung der
angiographischen Aufnahme mit Falschfarben. Dabei wird das Grauwertspektrum
oder ein Teil desselben durch ein Farbspektrum ersetzt (Abb.
18-D)
. Durch geschickte Anpassung der Lage und der Spanne des Farbspektrums
im ursprünglichen Grauwertspektrum lassen sich unterschiedliche Details
der Aufnahme hervorheben. Durch Einfärbung eines schmalen Grauwertbereichs lassen sich die Grenzen zwischen perfundierten und nicht perfundierten Aderhautarealen markieren. Andererseits lassen sich nicht fluoreszente Aderhautgebiete im Gesamten hervorheben, wenn man die dunkleren Bildanteile durch eine breiteres Farbspektrum ersetzt (Abb. 22ab) . Eine häufige Anwendung findet die Funktion Pseudocolor insbesondere zur Hervorhebung von Aderhautdurchblutungsstörungen. Mit diesem Verfahren läßt sich zwar nicht der Informationsgehalt der Aufnahme vergrößern, jedoch können die Grenzen der perfundierten Aderhautsegmente durch den Betrachter leichter beurteilt werden. |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 22ab Digitales Funduskamera-System (DFC-FLADOP, IOD = 55 mmHg) Pseudocolor |
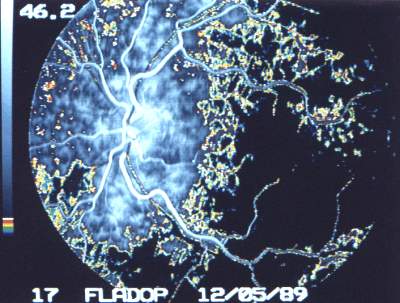
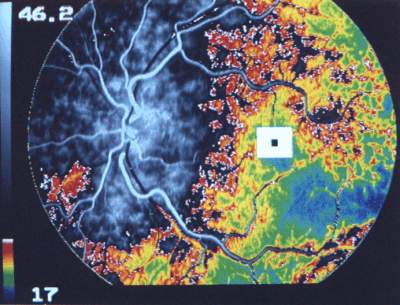
|
||||||||||||||||||||||||||||||||||||||||
|
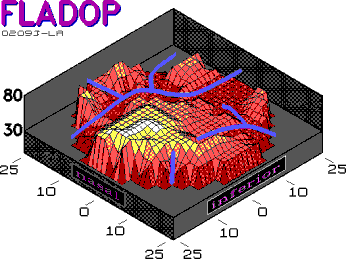
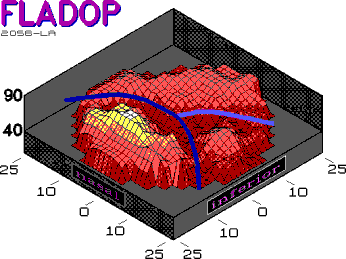
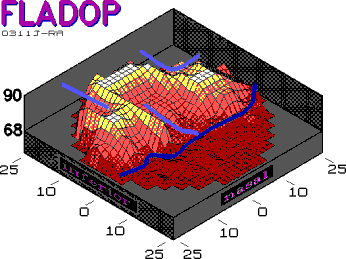
3.3. Analyse der Hauptwasserscheide |
Besonders in der lobulären Füllungsphase lassen sich die einzelnen
Segmente der Aderhaut sicher voneinander abgrenzen. Ihre Anordnung, Größe
und Anzahl kann unmittelbar an der Zeitlupenauswertung der Videoangiogramme
ermittelt werden. Obwohl bei der Sequenzangiographie und dem digitalen Funduskamerasystem
DFC-512 eine kontinuierliche Aufzeichnung nicht gegeben ist, können
wir durch den verlangsamten Einstrom des Fluoreszeins die Füllung der
einzelnen Aderhautsegmente deutlich differenzieren. Die Erstellung der Aderhautprofile
ist somit bei jedem der genannten Bildgewinnungsverfahren möglich (siehe
2.2.3.5.). Besonders die Auswertung der FLADOP als Aderhautprofil erweist sich als sehr hilfreich zur Berurteilung des Füllungsverlaufes und somit der segmentalen Gliederung der Aderhaut. In diesen dreidimensionalen Graphiken stellen sich die Zentren der Aderhautsegmente durch ihre frühe Fluoreszenz (bei hohen intraokularen Drucken) als " Gipfel " dar. Die Wasserscheiden, deren Aderhautlobuli erst bei niedrigen intraokularen Drucken fluoreszent werden, treten als " Täler " in Erscheinung. Anhand des Verlaufs und der Tiefe dieser Täler ist es möglich, diejenige Wasserscheide zu erkennen, welche die Aderhaut in eine nasale und temporale Hemisphäre teilt. Diese Wasserscheide nennen wir im folgenden " Hauptwasserscheide ", da sie die Grenze zwischen dem nasalen und dem temporalen ziliaren Versorgungsgebiet bildet. Sie ist gekennzeichnet durch einen vertikalen oder leicht schrägen Verlauf über den gesamten Fundusausschnitt. Ihre Lobuli füllen sich meist zuletzt in der Drucksenkungsphase der FLADOP (" tiefes Tal "). Innerhalb des temporalen und auch des nasalen ziliaren Versorgungsgebiets kommen weitere Wasserscheiden zur Darstellung ("Nebenwasserscheiden"). Sie sind kürzer als die Hauptwasserscheide und beenden ihre Füllung meist bei höheren intraokularen Drucken. Die Nebenwasserscheiden zeigen einen sehr variablen Verlauf und bestimmen die Lage, Größe und Form der einzelnen Aderhautsegmente in den Aderhauthemisphären. Wir haben die segmentale Füllung der Aderhaut analysiert und den Verlauf der Hauptwasserscheide bestimmten Lagetypen zugeordnet. |
||||||||||||||||||||||||||||||||||||||||
|
3.3.1. Typ 1 - Hauptwasserscheide zwischen Makula und Papille
|
In der Mehrzahl der von uns untersuchten Augen verläuft die Hauptwasserscheide
zwischen Makula und Papille. Wir finden diesen Typ bei insgesamt 15 Patienten.
Dies entspricht einem Anteil von 40,5 %. Da der Verlauf der Hauptwasserscheide
nach oben und unten weitere Besonderheiten zeigt, können wir hier 3
Subtypen unterscheiden : Typ 1a: papillokonkave Hauptwasserscheide zwischen Makula und Papille Die Hauptwasserscheide zieht in einem großen Bogen mit ihrer Konkavität zur Papille zwischen Makula und Papille hindurch. Eine solche Gren-ze zwischen nasaler und temporaler Fundushälfte läßt sich in 8 Augen (21,6 %) erkennen. Typ 1b: geradlinige Hauptwasserscheide zwischen Makula und Papille Die Hauptwasserscheide verläuft geradlinig zwischen Makula und Papille. Wir finden diesen Subtyp bei 5 Patienten (13,5 %). Sie ist dabei exakt vertikal (n = 3) oder auch leicht schräg ausgerichtet (n = 2). Typ 1c: papillokonvexe Hauptwasserscheide zwischen Makula und Papille Hier zeigt die Konvexität der Hauptwasserscheide in Richtung Papille, sodaß das nasale Aderhautversorgungsgebiet auch Areale, die ober- oder unterhalb der Makula liegen, erfaßt. Dieser seltene Typ wird bei 2 Augen, entsprechend einem Anteil von 5,4 %, beobachtet. |
||||||||||||||||||||||||||||||||||||||||
|
3.3.2. Typ 2 - transmakuläre Hauptwasserscheide 
|
Hier ist die Grenze zwischen nasaler und temporaler Fundushälfte nach temporal verschoben, wobei die Hauptwasserscheide die Makula erfaßt. Insgesamt können wir in 12 Augen eine transmakuläre Hauptwasserscheide beobachten (32,4 %). Auch hier kann die Hauptwasserscheide verschiedene Verläufe zur Peripherie zeigen. Meist hat die transmakuläre Hauptwasserscheide einen geradlinig vertikalen (n = 4) oder einen zur Papille konkaven Verlauf (n = 4). In 3 Augen zieht die Hauptwasserscheide schräg von nasal unten nach temporal oben durch die Makula, in einem Auge schräg von temporal unten nach nasal oben. | ||||||||||||||||||||||||||||||||||||||||
|
3.3.3. Typ 3 - transpapilläre Hauptwasserscheide 
|
Die Hauptwasserscheide erscheint bei diesem Typ als ein vertikales hypofluoreszentes Band, das direkt durch die Papille hindurchzieht. Die peripapilläre Aderhaut füllt sich hier erst bei niedrigen intraokularen Drucken. Gelegentlich kann man erkennen, wie verschiedene Aderhautsegmente das peripapilläre Gebiet unabhängig voneinander versorgen. Wir finden diesen Versorgungstyp bei 5 Augen. Dies entspricht einem Anteil von 13,5 %. | ||||||||||||||||||||||||||||||||||||||||
|
3.3.4. Typ 4 - Hauptwasserscheide nasal der Papille 
|
Bei 2 Augen (5,4 %) beobachtet man, wie die Makula von einem großen Aderhautsegment versorgt wird, dessen Fluoreszenz sich im Verlauf der FLADOP nach nasal über die Papille hinweg kontinuierlich ausbreitet. Die begrenzende Hauptwasserscheide liegt nasal der Papille. | ||||||||||||||||||||||||||||||||||||||||
|
3.3.5. Typ 5 - keine erkennbare Hauptwasserscheide 
|
Bei 3 Patienten (8,1 %) können wir keine Wasserscheide finden, die den
Fundus in eine nasale und temporale Hälfte teilt. Vielmehr füllt
sich sehr rasch während der Frühphase ein großes peripapilläres
Segment, das keine klaren Abgrenzungen zur Peripherie erkennen läßt.
Am Rande des angiographischen Fundusausschnitts sieht man Nebenwasserscheiden,
die dort kleinere dreieckige Aderhautsegmente demarkieren. In der Spätphase
der FLADOP erstreckt sich die Fluoreszenz des peripapillären Segments
über den gesamten hinteren Pol.
In Tabelle 5 ist zusammenfassend das Vorkommen der verschiedenen Hauptwasserscheiden aufgelistet. |
||||||||||||||||||||||||||||||||||||||||
|
Tab. 5 Vorkommen der Hauptwasserscheiden |
|
||||||||||||||||||||||||||||||||||||||||
|
3.4. Analyse der perimakulären Aderhautfüllung |
Die starke
Pigmentierung der Makularegion limitiert die fluoreszenzangiographische Beurteilbarkeit
der Aderhaut in diesem Bereich. Vor allem das Karotinoid Xantophyll absorbiert
einen großen Teil der Fluoreszenz der submakulären Aderhaut.
Aus diesem Grund können die großen Aderhautgefäße im Bereich der Makula mit der Fluoreszenzangiographie bei absinkendem Augeninnen-druck in der Regel nicht dargestellt werden. Mit dem Eintritt des Fluoreszeins in die Choriokapillaris lassen sich jedoch die Aderhautsegmente und Wasserscheiden am hinteren Pol sehr weit in die Makula verfolgen. Bei gering pigmentierten Augen ist es möglich, den Verlauf der Wasserscheiden durch die Makularegion zu beobachten. Trotzdem muß betont werden, daß eine Analyse der Aderhautperfusion der Makula nur mit Einschänkungen erfolgen kann Wir haben den lobulären Füllungsverlauf der perimakulären Aderhaut untersucht und nach verschiedenen Füllungsmustern eingeteilt. Bei der Zuordnung der einzelnen Angiogramme zu bestimmten makulären Füllungsmustern wurden folgende Aspekte berücksichtigt:
|
||||||||||||||||||||||||||||||||||||||||
|
3.4.1. Typ 1 - transmakuläre Wasserscheide 
|
Während
der Drucksenkungsphase erscheint die erste lobuläre Aderhautfluoreszenz
in verschiedenen temporalen Segmenten. Mit der Ausbreitung des Farbstoffes
in den Segmenten lassen sich die verschiedenen Wasserscheiden als hypofluoreszente
Bänder, die zur Makula ziehen, erkennen (Abb. 23)
. Die Makula selbst wird somit von mehreren Segmenten des hinteren Pols versorgt. Liegt eine Hauptwasserscheide in der Makularegion, so wird der nasale Anteil der Makula vom peripapillären Segment versorgt. Ist die Hauptwasserscheide weiter nasal lokalisiert (meist zwischen Makula und Papille), so finden wir bei diesem Typ mehrere Segmente der temporalen Fundushälfte, deren Begrenzungen als Nebenwasserscheiden die Makula erreichen. In insgesamt 19 Augen (51,3 %) liegt die Makula im Bereich zumindest einer Wasserscheide. Wie bereits in Kapitel 3.3.2. ausgeführt, handelt es sich hierbei in 13 Augen (35,1 %) um eine Hauptwasserscheide, die den Fundus in eine nasale und temporale Hemisphäre teilt. In 6 Augen erreicht außerdem eine weitere Nebenwasserscheide die Makula. In 3 Augen sehen wir zwei weitere Nebenwasserscheiden zur Makula laufen. Bei 4 Augen liegt die Hauptwasserscheide isoliert im Bereich der Makula (Abb. 24) . Bei 6 Augen (16,2 %) finden wir in der Makularegion nur Nebenwasserscheiden, da hier die Hauptwasserscheide nasal der Makula liegt. In jeweils 3 Augen können wir 2 beziehungsweise 3 Nebenwasserscheiden erkennen, die die Makula erfassen. |
||||||||||||||||||||||||||||||||||||||||
|
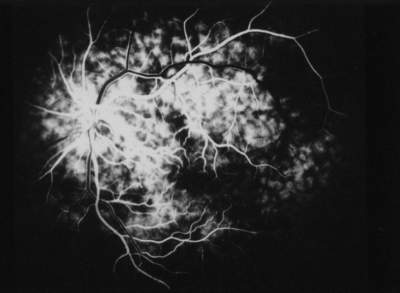
Abb. 23 transmakuläre Wasserscheiden (FLADOP, IOD = 90 mmHg) Peripapilläres Segment und drei temporale Segmente. Die Wasserscheiden laufen in der Makula zusammen. |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 24 isolierte Hauptwasserscheide ohne Nebenwasserscheiden |
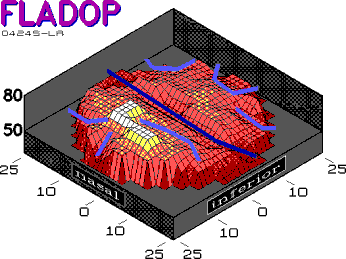
|
||||||||||||||||||||||||||||||||||||||||
|
3.4.2. Typ 2 - Aderhautsegment der Makula 
|
Im Gegensatz
zu dem zuvor besprochenen Füllungsmuster finden wir hier keine Wasserscheiden
im Gebiet der Makula. Durch den hohen Pigmentgehalt der Makula sehen wir
zunächst keine Fluoreszenz in diesem Bereich. Jedoch in der späteren
Phase der FLADOP beobachten wir die zentripetale Ausweitung einer lobulären
Füllung, die ihr Zentrum in der Makula zu haben scheint. Bei 2 Fundi
mit geringerer Pigmentierung läßt sich dieses zentrale Füllungsmuster
früher beoachten und das zentrale Makulasegment genauer differenzieren.
Die entsprechenden Aderhautprofile (Abb. 25)
verdeutlichen, wie das makuläre Segment von einer fast zirkulären
Wasserscheide umgeben wird, die es von weiter peripher liegenden Segmenten
und auch von dem peripapillären Segment abgrenzt.
Eine solchen (peri-)makulären Füllungsverlauf können wir in 5 Augen feststellen. Dies entspricht einem Anteil von 13,5 %. Einschränkend muß darauf hingewiesen werden, daß die Beurteilbarkeit der makulären Aderhautabschnitte durch die hohe interindividuelle Variabilität des Pigmentgehalts stark beeinfluß wird. Sicherlich verhindert eine stärkere Pigmentierung das Erkennen eines Makulasegments, sodaß der Anteil dieses Füllungmusters am Gesamtkolektiv höher liegen kann. |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 25 Aderhautsegment der Makula |
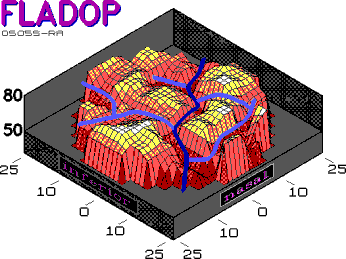
|
||||||||||||||||||||||||||||||||||||||||
|
3.4.3. Typ 3 - paramakuläres Segment 
|
Auch bei diesem Füllungsmuster können wir keine Wasserscheiden erkennen, die die Makula tangieren. Die Makula wird von einem Aderhautsegment versorgt, dessen Zentrum in der temporalen Fundushälfte liegt (Abb. 26) . Die erste lobuläre Fluoreszenz dieses Segments kann unmittelbar paramakulär (Abb. 27) oder auch weiter peripher erscheinen. Bei langsam absinkendem Augeninnendruck breitet sich die Farbstofffront über die Makula aus. Die das Segment begrenzende Wasserscheide liegt jenseits der Makula. Dieses Füllungsmuster der Makula finden wir bei 8 Augen (21,6 %). | ||||||||||||||||||||||||||||||||||||||||
|
Abb. 26 paramakuläre Segmente oben und nasal unten |
|
||||||||||||||||||||||||||||||||||||||||
|
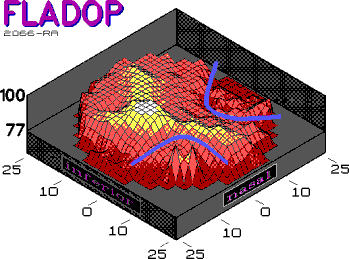
Abb. 27 paramakuläres Segment (FLADOP, IOD = 100 mmHg) Das Zentrum des Segments liegt nasal der Makula, Ausbreitung der lobulären Füllung nach temporal |
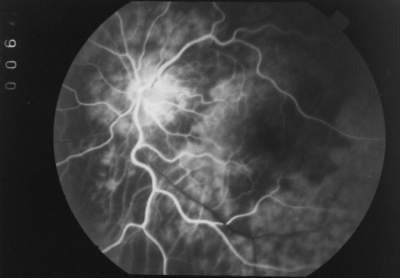
|
||||||||||||||||||||||||||||||||||||||||
|
3.4.4. Typ 4 - peripapilläres Segment versorgt Makula 
|
Als Sonderform des vorherigen Füllungstypes wird die Makula von dem
peripapillären Segment mitversorgt. In der Frühphase der FLADOP
füllt sich zunächst nur ein großes peripapilläres Segment.
Im weiteren Verlauf breitet sich die lobuläre Füllung kontinuierlich
über die Makula hinweg nach temporal aus (Abb. 28-29)
. Zentrale Wasserscheiden finden sich nicht. Gegebenenfalls können
nur periphere Nebenwasserscheiden beobachtet werden, die kleinere dreieckige
Aderhautsegmente abgrenzen. Eine solche Ausdehnung des peripapillären Segments nach zentral können wir in 3 Augen (8,1 %) feststellen. Die Tabelle 6 faßt die verschiedenen Füllungsmuster der Makularegion zusammen. |
||||||||||||||||||||||||||||||||||||||||
|
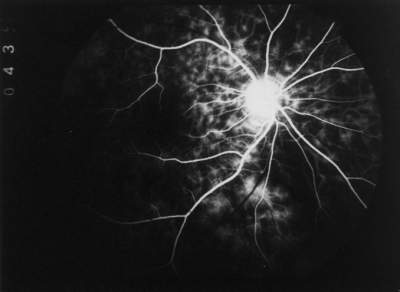
Abb. 28 peripapilläres Segment versorgt Makula |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 29 peripapilläres Segment (FLADOP, IOD = 69 mmHg) Die lobuläre Füllung breitet sich gleichmäßig von der Papille über Makula hinaus aus. |
|
||||||||||||||||||||||||||||||||||||||||
|
Tab. 6 Füllungsmuster der Makularegion |
|
||||||||||||||||||||||||||||||||||||||||
|
3.5. Analyse der peripapillären Aderhautfüllung |
Im Folgenden
haben wir die FLADOP's nach der Art ihrer peripapillären Füllung
beurteilt. Folgende angiographischen Charakteristika wurden bei der Zuordnung
der einzelnen Aufnahmen zu einem bestimmten peripapillären Füllungstyp
herangezogen:
|
||||||||||||||||||||||||||||||||||||||||
|
3.5.1. Typ 1 - Peripapilläres Segment 
|
Charakteristisch
für diesen Typ ist die frühe Darstellung großer Aderhautgefäße,
die ihren Skleradurchtritt unmittelbar am Papillenrand haben. Bei weiter absinkendem
Augeninnendruck läßt sich ihr radiärer Verlauf zur Makula
und zur Peripherie verfolgen. Sie besitzen meist einen großen Durchmesser
und zeigen mehrere dichotome oder asymmetrische Verzweigungen.
Auch die lobuläre Füllungsphase hat ihren Beginn unmittelbar am Papillenrand und setzt sich zentrifugal fort. Somit erscheint um die Papille das für diesen Füllungstyp kennzeichnende Aderhautsegment (Abb. 30) . Die temporale Ausdehnung des peripapillären Segments wird meist durch eine senkrecht zwischen Makula und Papille hindurchziehende Wasserscheide bestimmt. Der Verlauf dieser Wasserscheide bestimmt die Form des peripapillären Segments. Bei einer zur Papille konkav verlaufenden Wasserscheide fällt das peripapilläre Segment durch seine runde Form auf, wobei die Abgrenzung des Segments nach oben und unten häufig leicht möglich ist (Typ 1a, Abb. 30+31 ). Liegt dagegen diese Wasserscheide mit ihrer Konvexität zur Papille, so ist das peripapilläre Segment meist nach temporal oben und temporal unten ausgezogen. Die oberen und unteren Grenzen des Segments sind dann schwer zu differenzieren (Typ 1b, Abb. 32 ). Nach nasal erreicht das peripapilläre Segment meist eine Ausdehnung, die über den angiographisch erfaßten Fundusausschnitt hinausgeht. Gelegentlich jedoch wird es durch eine nasal der Papille gelegene Wasserscheide von weiter peripher liegenden Aderhautsegmenten abgetrennt. Ein peripapilläres Segment finden wir in 19 Augen. Dies entspricht einem Anteil von 51,4 %. Dabei füllt sich in 15 Augen das peripapilläre Segment vor allen anderen Aderhautsegmenten. In den restlichen 4 Fällen liegt die erste lobuläre Aderhautfluoreszenz in der temporalen Fundushälfte. |
||||||||||||||||||||||||||||||||||||||||
|
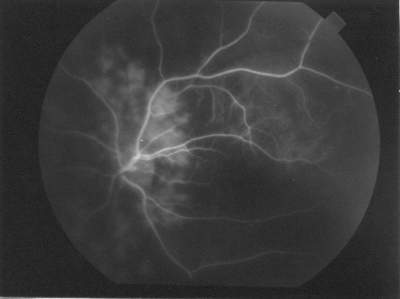
Abb. 30 peripapilläres Segment (FLADOP, IOD = 71 mmHg) |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 31 peripapilläres Segment mit zur Papille konkaver Wasserscheide. Beachte die späte Füllung der Wasserscheiden. |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 32 peripapilläres Segment mit zur Papille teils konvexer Wasserscheide. |
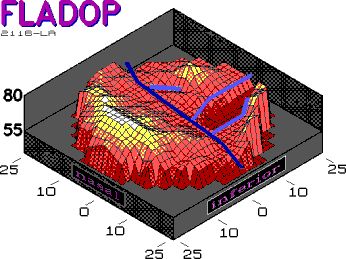
|
||||||||||||||||||||||||||||||||||||||||
|
3.5.2. Typ 2 - transpapilläre Wasserscheide 
|
Während
der Augeninnendruck langsam absinkt, zeigt sich die erste Aderhautfluoreszenz
in verschiedenen Aderhautsegmenten, die nicht unmittelbar an die Papille
grenzen. Mit zunehmender Ausdehnung der lobulären Füllung zur Papille
hin, erkennt man deutlich eine Wasserscheide, die die Papille durchkreuzt
(Abb. 33)
. Die einzelnen Segmente, die somit an Versorgung der peripapillären Aderhaut beteiligt sind, füllen sich während der FLADOP völlig unabhängig voneinander bei unterschiedlichen intraokularen Drucken. Dieser peripapilläre Füllungstyp wird bei 11 Augen (32,4%) beobachtet . Bei 5 dieser Augen bildet die Wasserscheide, welche die Papille durchläuft, gleichermaßen die Grenze zwischen dem nasalen und temporalen Versorgungsgebiet (Hauptwasserscheide). Die Wasserscheide und somit auch die peripapilläre Aderhaut füllen sich hier sehr spät und teilen den Fundus in eine nasale und temporale Hemisphäre (Abb. 34) . Bei weiteren 5 Probanden stellt die transpapilläre Wasserscheide nur eine Grenze zwischen kleineren Aderhautsegmenten der nasalen Hemisphäre dar (Abb. 35) . Die Hauptwasserscheide liegt hier temporal der Papille. Bei einem Angiogramm war eine Beziehung der transpapilläre Wasserscheide zur gesamten Aderhaut nicht eindeutig bestimmbar. |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 33 transpapilläre Wasserscheide (FLADOP, IOD = 60 mmHg) temporale und nasale Aderhauthemisphäre sind bereits homogen fluoreszent, während die Hauptwasserscheide in die lobuläre Füllungsphase eintritt |
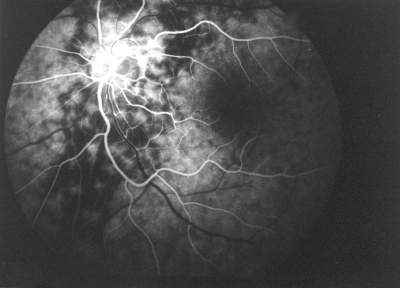
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 34 transpapilläre Hauptwasserscheide (dunkelblau). Die temporale Aderhauthemisphäre wird durch weitere Wasserscheiden (hellblau) in verschiedene Segmente unterteilt. Die Hauptwasserscheide füllt sich zuletzt. |
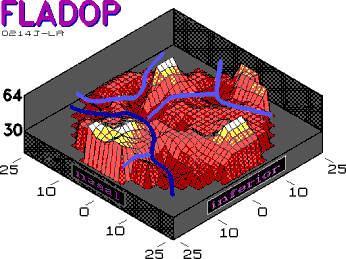
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 35 transpapilläre Nebenwasserscheide (hellblau). Die Hauptwasserscheide (dunkelblau) verläuft von temporal oben nach nasal unten und bleibt lange hypofluoreszent. |
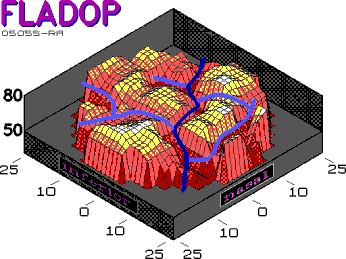
|
||||||||||||||||||||||||||||||||||||||||
|
3.5.3. Typ 3 - verzögerte peripapilläre Füllung (nasale Füllungsverzögerung) 
|
Bei diesem Füllungstyp kommt die peripapilläre Choriokapillaris
erst bei niedrigen intraokularen Drucken zur Darstellung. Im Gegensatz zu
Typ 1 bzw. Typ 2 ist weder eine transpapilläre Wasserscheide noch ein
spätes peripapilläres Segment zu erkennen (Abb.
36 + 37)
. Dieser Typ entspricht einer Verzögerung der Aderhautfüllung in der nasalen Hemisphäre, wobei die Hauptwasserscheide temporal der Papille liegt. Temporale Aderhautsegmente sind in ihrem Zentrum bereits diffus angefärbt, während peripapillär noch größere Aderhautgefäße vor dem Beginn der lobulären Füllungsphase zu sehen sind. Die lobulären Füllung zeigt keine besondere Orientierung und beginnt an mehreren Stellen. Eine verzögerte Füllung der peripapillären Aderhaut läßt sich in 5 Augen nachweisen, wobei es sich bei einem Auge mit Sicherheit um einen pathologischen Befund handelt (s.u.). |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 36 verzögerte peripapilläre Füllung (FLADOP, IOD= 60 mmHg) Die temporale Aderhauthälfte ist bereits lobulär gefüllt, während peripapillär und nasal noch keine Fluoreszenz zu erkennen ist. |
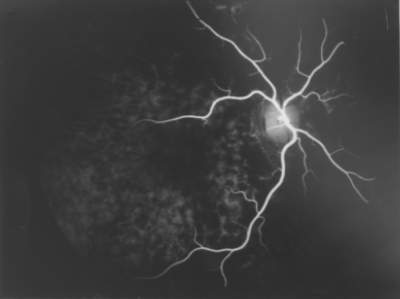
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 37 verzögerte peripapilläre Füllung |
|
||||||||||||||||||||||||||||||||||||||||
|
3.5.4. Typ 4 - diffuse peripapilläre Aderhautfüllung 
|
Frühzeitig füllt sich die peripapilläre Aderhaut als Teil
eines größeren Segments, wobei die erste Aderhautfluoreszenz jedoch
außerhalb des peripapillären Gebiets liegt. Eine transpapilläre
Wasserscheide erkennt man nicht. (Abb. 38)
Dieses peripapilläre Füllungsmuster ließ sich bei 2 Augen nachweisen. In Tabelle 7 ist das Vorkommen der verschiedenen peripapillären Füllungstypen aufgeschlüsselt. |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 38 diffuse peripapilläre Aderhautfüllung |
|
||||||||||||||||||||||||||||||||||||||||
|
Tab. 7 Vorkommen der peripapillären Füllungstypen |
|
||||||||||||||||||||||||||||||||||||||||
|
3.6. Perfusionsparameter der Aderhaut |
Da der
Einstrom des Fluoreszeins in das retinale und choroidale Gefäßbett
in Abhängigkeit vom augenblicklich herrschenden intraokularen Druck
geschieht, müssen für die Fluoreszenzangiographie unter absinkendem
Augeninnendruck neue Perfusionsparameter entwickelt werden.
Um das Füllungsverhalten der Aderhaut während der FLADOP quantitativ bewerten zu können, haben wir angiographische Parameter in Abhängigkeit vom intraokularen Druck definiert. Diese Parameter stehen in unmittelbaren Zusammenhang mit der Darstellung der Aderhautperfusion als Aderhautprofil. |
||||||||||||||||||||||||||||||||||||||||
|
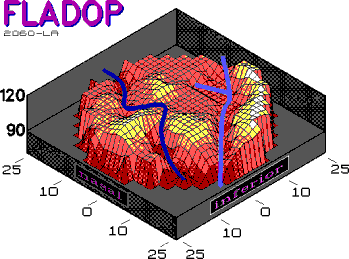
3.6.1. erste lobuläre Aderhautfüllung (AH1) |
Während
der Drucksenkungsphase erkennt man, wie sich nach der Füllung der tiefliegenden
Aderhautgefäße erste Aderhautlobuli der Choriokapillaris mit Fluoreszein
anfärben. Unabhängig von der Lokalisation der zuerst füllenden
Aderhautlobuli definieren wir die
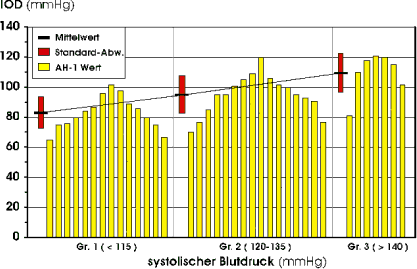
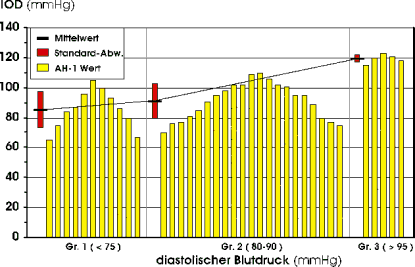
Um den Einfluß des arteriellen Blutdrucks auf den AH1-Wert zu überprüfen, wurde das Gesamtkollektiv zusammengefaßt und getrennt für systolische und diastolische Blutdruckwerte in 3 Gruppen eingeteilt ( Tab. 8 , Abb. 39). Mit Zunahme des systolischen Blutdrucks erhöht sich der mittlere AH1-Wert von 82,9 mmHg (Gruppe S1) über 95,3 mmHg (Gruppe S2) auf 110,0 mmHg (Gruppe S3). Unter Berücksichtigung des diastolischen Blutdrucks steigt der mittlere AH1-Wert von 85,3 mmHg (Gruppe D1) über 91,2 mmHg (Gruppe D2) auf 119,0 mmHg (Gruppe D3). |
||||||||||||||||||||||||||||||||||||||||
|
Tab. 8 erste lobuläre Aderhautfüllung (AH1) in mmHg M = Mittelwert S = Standardabweichung N = Patienten |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 39 Einfluß des systolischen und diastolischen Blutdrucks auf den AH1-Wert |
|
||||||||||||||||||||||||||||||||||||||||
|
3.6.2. vollständige lobuläre Aderhautfüllung (AH100) |
Mit der
fortschreitenden Normalisierung des intraokularen Drucks werden weitere Aderhautlobuli
perfundiert bis schließlich die lobuläre Füllungsphase den
gesamten sichtbaren Fundusausschnitt erfaßt. Die sich zuletzt füllenden
Aderhautlobuli liegen meist im Bereich der Wasserscheiden oder verzögert
erscheinender Aderhautsegmente. Unabhänigig von der Lokalisation der
zuletzt füllenden Aderhautlobuli definieren wir die
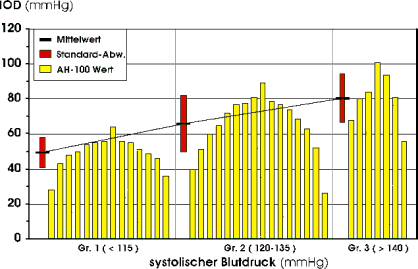
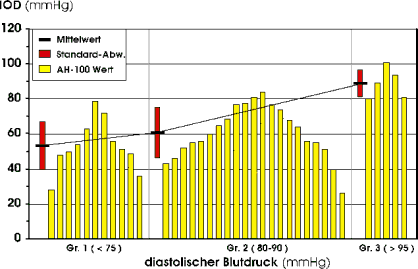
Der Einfluß des arteriellen systolischen und diastolischen Blutdrucks auf den AH100-Wert sind in Tab. 9 und Abb. 40 dargestellt. Die einzelnen Gruppen sind wie für AH1 definiert. Für die Gruppe S1 beträgt der mittlere AH100-Wert 49,4 mmHg. Mit Zunahme des systolischen Blutdrucks erhöht er sich auf 65,8 mmHg (Gruppe S2) beziehungsweise auf 80,6 mmHg (Gruppe S3). Unter Berücksichtigung des diastolischen Blutdrucks steigt der mittlere AH100-Wert von 53,3 mmHg (Gruppe D1) über 60,8 mmHg (Gruppe D2) auf 89,0 mmHg (Gruppe D3). |
||||||||||||||||||||||||||||||||||||||||
|
Tab. 9 vollständige lobuläre Aderhautfüllung (AH100) in mmHg M = Mittelwert S = Standardabweichung N = Patienten |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 40 Einfluß des systolischen und diastolischen Blutdrucks auf den AH100-Wert |
|
||||||||||||||||||||||||||||||||||||||||
|
3.6.3. AH-PDS : Perfusionsdruckspanne der Aderhaut |
Aus beiden
voran beschriebenen Parametern errechnet sich die
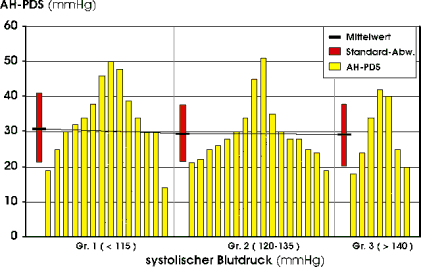
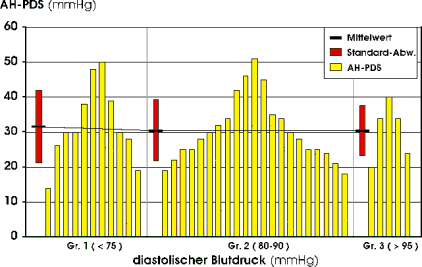
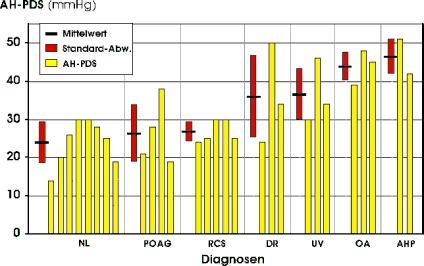
Auch hier haben wir zunächst die Perfusionsdruckspanne in Abhängigkeit vom systemischen Blutdruck analysiert. (Tab. 10, Abb. 41 ) Auffallend ist, daß dieser Parameter in keinem Zusammenhang mit dem aktuellen systemischen Blutdruck zu stehen scheint. So ist die mittlere AH-PDS in allen drei Gruppen nahezu gleich oder selbst identisch (Gruppe D2 - D3). Die gilt sowohl für den systolischen als auch für den diastolischen Blutdruck. Bemerkenswert ist außerdem, daß die interindividuelle Schwankungsbreite der AH-PDS recht beachtlich ist. Die Werte liegen im Gesamtkollektiv zwischen 14 und 51 mmHg. Zur weiteren Analyse dieses Parameters wurden die untersuchten Augen nach ihren Hauptdiagnosen in 7 Gruppen eingeteilt (Tab. 11 , Abb. 42 ). In der Gruppe der augengesunden Probanden (NL) finden wir mit 24,0 mmHg die kleinste mittlere Perfusionsdruckspanne. Ist die mittlere Perfusionsdruckspanne bei Patienten mit primärem Offenwinkelglaukom und Retinopathia centralis serosa nur gering erhöht (26,5 und 26,8 mmHg), so steigt sie in der Gruppe der diabetischen Retinopathie und Uveitis posterior auf 36,0 bzw. 36,7 mmHg. Für die ischämischen Optikus-Atrophien und die Aderhaut-Perfusionsstörungen (sekundäre Aderhaut-Perfusionsstörung bei Morbus Eales und primäre Aderhaut-Perfusionsstörung ) erhöht sie sich weiter auf 44,0 mmHg beziehungsweise 46,5 mmHg. Die kürzesten individuellen Perfusionsdruckspannen finden wir mit 14 und 19 mmHg bei zwei augengesunden Probanden. Die entsprechenden Aderhautprofile zeigen durch ihren flachen Verlauf die rasche und gleichmäßige Ausbreitung der lobulären Füllungsphase. Die längsten Perfusionsdruckspannen werden einem Patienten mit Morbus Eales und bei diabetischer Retinopathie gemessen (51 bzw. 50 mmHg). |
||||||||||||||||||||||||||||||||||||||||
|
Tab. 10 Perfusionsdruckspanne der Aderhaut (mmHg) M = Mittelwert S = Standardabweichung N = Patienten |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 41 Einfluß des systolischen und diastolischen Blutdrucks auf die Perfusionsdruckspanne der Aderhaut (AH-PDS) |
|
||||||||||||||||||||||||||||||||||||||||
|
Tab. 11 Perfusionsdruckspanne der Aderhaut (mmHg) M = Mittelwert S = Standardabweichung N = Patienten |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 42 Perfusionsdruckspanne der Aderhaut (AH-PDS) bei verschiedenen ophthalmologischen Diagnosen |
|
||||||||||||||||||||||||||||||||||||||||
|
3.7. Fallbeispiele |
Im Folgenden soll an verschiedenen Netzhaut- und Aderhaut-erkrankungen der Beziehung zwischen AH-PDS, Aderhautprofil und angiographischem Korrelat besprochen werden. | ||||||||||||||||||||||||||||||||||||||||
|
3.7.1. Aderhautprofil beim Augengesunden |
Wie bereits
in Kapitel 3.1.
beschrieben, können mit Hilfe der FLADOP verschiedene Füllungsphasen
der Aderhaut erkannt werden. Charakteristisch für die Aderhautfüllung
beim Gesunden ist einerseits ihr rascher Verlauf, andererseits die kontinuierliche
Ausbreitung der lobulären Füllung der Choriokapillaris ausgehend
von den einzelnen Aderhaut-segmenten.
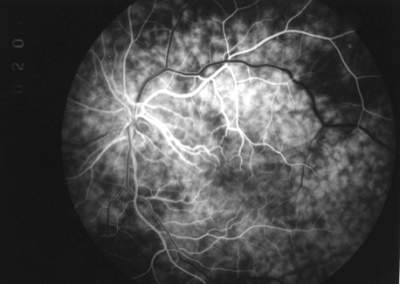
Bei bestimmten intraokularen Drucken kann man beobachten, daß das Zentrum eines Aderhautsegments bereits die diffuse Füllungsphase der Aderhaut zeigt, während zum Rande des Segments hin noch einzelne Lobuli differenziert werden können (lobuläre Füllungsphase). Die angrenzende Wasserscheide zeigt die Füllungsphase der großen Aderhautgefäße. Die Übergänge zwischen den Phasen sind fließend (Abb. 43) . Diese konstante Aufeinanderfolge der Füllungsphasen gilt nicht nur für den Füllungsstatus des Fundus bei einem bestimmten intraokularen Druck (räumliche Folge der Füllungsphasen), sondern auch für das Füllungsverhalten eines definierten Aderhautbezirks im Verlauf der Drucksenkungsphase (druckabhängige Folge der Füllungphasen). Sowohl für die Entwicklung der Perfusionsparameter als auch für die Erstellung der Aderhautprofile haben wir uns an der lobulären Füllungsphase der Choriokapillaris orientiert. Da die Perfusionsdruckspanne der Aderhaut bei augengesunden Probanden besonders kurz ist, kann man erwarten, daß die Aderhautprofile ein entsprechend flaches Relief zeigen. Die in den folgenden Kapiteln gezeigten Aderhautprofile besitzen für ihre Z-Achse einen identischen Maßstab und können somit direkt miteinander verglichen werden. Als Beispiel seien hier die Aderhautprofile zweier augengesunden Probanden gezeigt (Abb. 44 + 45 ). Die Profile sind entsprechend der kleinen Aderhautperfusionsdruckspannen (AH-PDS) sehr flach. Die gleichmäßige Ausbreitung des Fluoreszeins in den Segmenten ergibt ein homogenes Aderhautprofil, d.h. es sind keine verzögerten Aderhautbezirke oder Wasserscheiden zu erkennen. Die AH-PDS liegt bei 14 mmHg bzw. 20 mmHg (Abb. 44 + 45 ). |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 43 augengesunder Proband (IOD = 60 mmHg) |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 44 C.L., männlich, 20 Jahre Normalbefund |
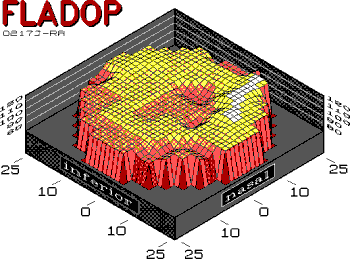
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 45 D.V. weiblich, 66 Jahre Normalbefund |
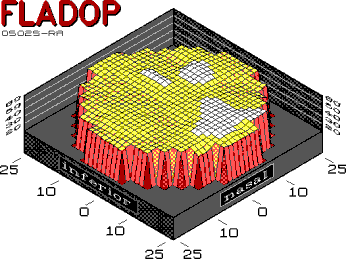
|
||||||||||||||||||||||||||||||||||||||||
|
3.7.2. Retinopathia diabetica |
Bei Patientin
T.M, 62 Jahre alt, ist seit 23 Jahren ein Diabetes mellitus Typ II bekannt.
Sie wurde von ihrem Augenarzt zur Fluoreszenzangiographie in die Augenklinik
Mainz überwiesen. Subjektiv klagt die Patientin über eine zunehmende
Sehverschlechterung in den letzten Monaten, vor allem am linken Auge.
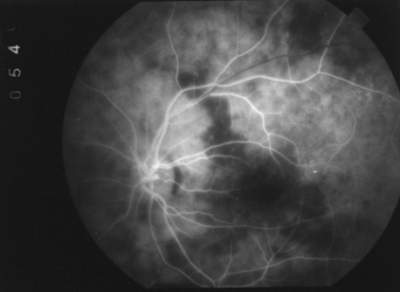
Der korrigierte Fernvisus beträgt 0,6 rechts und 0,25 links. Die Spaltlampenuntersuchung ergibt einen altersentsprechende Befund der vorderen Augenabschnitte und der brechenden Medien. Applanationstonometrisch liegt der Augeninnendruck bei 16 mmHg beidseits. Ophthalmoskopisch findet sich das Bild einer diabetischen Hintergrund-Retinopathie mit multiplen harten Exudaten und flohstichartigen intraretinalen Blutungen am hinteren Pol. Das linke Auge zeigt im Bereich der Makula neben harten Exudaten auch eine deutliche Pigmentumschichtung und -verklumpung. Im Bereich des unteren temporalen Gefäßbogens erkennt man eine präretinale Blutung. Das Kaliber der Arteriolen erscheint unregelmäßig, die Venolen sind dilatiert. Die Papille ist vital und randscharf. Am linken Auge wurde eine FLADOP durchgeführt. Während der Drucksenkungsphase füllt sich zunächst ein peripapilläres Aderhautsegment, dessen temporale Begrenzung unmittelbar nasal der Makula liegt. Im weiteren Verlauf treten in der temporalen Hemisphäre zwei weitere Aderhautsegmente hinzu. Die Wasserscheiden zwischen den einzelnen Segmenten treffen sich in der Makula (Typ 1 der perimakulären Aderhautfüllung). Unterhalb eines intraokularen Drucks von 54 mmHg sistiert die Ausbreitung der lobulären Füllung zur Makula hin. Vielmehr nimmt die diffuse Fluoreszenz im Bereich der Segmente weiter zu und demarkiert sich deutlich von den hypofluoreszenten transmakulären Wasserscheiden ( Abb. 46 ). Dieses unmittelbare Nebeneinander von bereits vollständig gefüllten Aderhautlobuli und noch nicht gefüllten Aderhautlobuli findet sich nicht bei augengesunden Probanden und muß als Perfusionsstörungen betrachtet werden. Erst nach einer Drucksenkung unter 31 mmHg ist das zentrale Füllungsdefizit ausgeglichen. In der Spätphase der FLADOP erkennt man großflächige Fluoreszeinaustritte temporal der Makula. Das retinale Kapillarbett ist rarefiziert, man findet multiple Non-Perfusion-Areale. Desweiteren zeigt sich ein beginnendes zystoides Makulaödem. Die verzögerte Füllung im Bereich der Wasserscheiden äußert sich im Aderhautprofil als tiefe, breite Senken, die die Makula erfassen (Abb. 47 ). In dieser Darstellung wird der Unterschied zum Augengesunden besonders deutlich (vgl. Abb. 44 + 45 ). Auch die Perfusiondruckspanne ist im Vergleich zum augengesunden Kontrollkollektiv (24,5 mmHg ± 5,4) hochsignifikant verlängert (x ± 3s, Irrtumswahrscheinlichkeit = 1%). Sie beträgt hier 50 mmHg. Diese Befunde der FLADOP sind Ausdruck einer Choriopathie bzw. einer Choriokapillaropathie bei Diabetes Mellitus. Betroffen sind hier die Wasserscheiden als Endstromgebiete ('letzte Wiesen') des choroidalen Gefäßbettes. |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 46 T.M., weiblich, 62 Jahre diabetische Makulopathie (IOD = 54 mmHg) |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 47 T.M., weiblich, 62 Jahre diabetische Makulopathie |

|
||||||||||||||||||||||||||||||||||||||||
|
3.7.3. primäre Aderhaut-Durchblutungsstörung |
Patientin
S.A., 18 Jahre alt, bemerkte vor vier Tagen eine Sehverschlechterung am rechten
Auge. Die Beschwerden waren plötzlich während eines Saunabesuchs
aufgetreten. Die Patientin erkannte selbst, daß für das rechte
Auge ein schwarzer Schatten im temporalen Gesichtsfeld bestand. Obwohl sich
die Beschwerden innerhalb der nächsten beiden Tage zurückbildeten,
stellte sich die Patientin bei ihrem Augenarzt vor. Hier wurde eine Gesichtsfeldprüfung
durchgeführt, wobei relative Gesichtsfeldausfälle temporal des blinden
Flecks festgestellt wurden. Mit der Frage nach weiterer Abklärung wurde
die Patientin in die Augenklinik überwiesen.
Die Allgemeinanamnese und die Augenanamnese der Patientin sind unauffällig. Die zentrale Sehschärfe beträgt mit Korrektur (-3,5 D sph. bds.) beidseits 1,0. Die Tensio liegt im Normbereich (12 / 13 mmHg). Der Spaltlampenbefund der vorderen Augenabschnitt ist regelrecht. Ophthalmoskopisch lassen beide Fundi mit vitaler, randscharfer Papille, unauffälliger Makula und normalen Gefäßen einen regelrechten Befund erkennen. Die durchgeführte Computer-Perimetrie (Octopus) ergibt eine unspezifische Dämpfung im peripheren Gesichtsfeld rechts. Subjektiv war die Patientin zum Zeitpunkt der Untersuchung völlig beschwerdefrei. Am gleichen Tage wurde bei der Patientin eine FLADOP durchgeführt. Im Verlauf der angiographischen Aufnahme erkennt man, wie sich die temporale Fundushälfte unauffällig füllt. Die lobuläre Füllungsphase nimmt hier ihren Ausgang von vier verschiedenen temporalen Aderhautsegmenten (Abb. 49 ). Bei einem intraokularen Druck von 55 mmHg ist die lobuläre Füllungsphase der temporalen Fundushälfte abgeschlossen, während nasal der Papille die Füllung der großen Aderhautgefäße noch nicht begonnen hat. Auffallend ist außerdem, daß an der Grenzlinie zwischen den beiden Gebieten vollständig gefüllte Aderhautlobuli und nicht fluoreszente Aderhautlobuli unmittelbar nebeneinander liegen ( Abb. 48 ). Eine solche Demarkierungslinie finden wir nicht bei Augengesunden. Erst unter einem intraokularen Druck von 30 mmHg füllt sich bei der Patientin auch die nasale Choriokapillaris. Das Aderhautprofil (Abb. 49 ) zeigt die entsprechende Füllungsverzögerung mit einem steilen Abfall des Profils nach nasal. Aufgrund der größflächigen Verzögerung läßt sich schließen, daß hier eine Perfusionsstörung eines nasalen Hauptastes der hinteren Ziliargefäße vorliegt. Die Perfusionsdruckspanne der Aderhaut (AH-PDS) ist mit 51 mmHg gegenüber dem augengesunden Kontrollkollektiv hochsignifikant verzögert (Irrtumswahrscheinlichkeit = 1%) und somit als pathologisch anzusehen. Da bei der Patientin keine allgemein-internistischen Erkrankungen vorliegen, die als Ursache dieser Durchblutungsstörung gewertet werden können, muß hier eine primäre Aderhautperfusionsstörung angenommen werden. |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 48 S.A.., weiblich, 18 Jahre primäre Aderhaut-Durchblutungsstörung der medialen hinteren Hauptziliararterie (IOD = 60 mmHg) |

|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 49 S.A.., weiblich, 18 Jahre primäre Aderhaut-Durchblutungsstörung mit nasal verzögerter Füllung der Aderhaut |

|
||||||||||||||||||||||||||||||||||||||||
|
3.7.4. Morbus Eales |
Patient
C.K., männlich, 50 Jahre alt, hatte erstmals 8 Jahre zuvor eine Sehverschlechterung
auf dem rechten Auge bemerkt. Damals wurde die Diagnose eines Venolenast-Verschlusses
gestellt. In den folgenden Jahren kam es am rechten Auge zu rezidivierenden
Glaskörperblutungen, die in der Folge zur Ausbildung traktiver Glaskörperverdichtungen
führten. Aufgrund der Klinik und des Verlaufs der Erkrankung wurde die
Diagnose Morbus Eales gestellt.
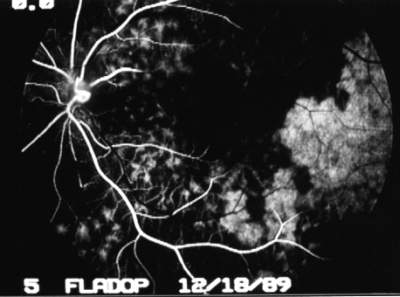
Aktuell wurde der Patient in unserer Klinik wieder vorgestellt wegen einer plötzlichen weiteren Visusverminderung an rechten Auge mit einem Absinken der zentralen Sehschärfe von 0,25 auf Fingerzählen (30 cm). Als Ursache der Visusminderung kann eine erneute massive Glaskörperblutung nachgewiesen werden. Da der Patient angibt, daß ebenfalls die Sehleistung seines besseren linken Auges (korrigierter Fernvisus 1,0) abgenommen habe, wird in der weiteren Diagnostik eine Computerperimetrie (Octopus) und eine FLADOP durchgeführt. Die Perimetrie des linken Auges ergibt ein kleines relatives Skotom parazentral und ein großes absolutes Skotom im nasal peripheren Gesichtsfeld. In der rotfreien Aufnahme des linken Auges erkennt man entlang der nasalen Gefäßbögen kleine harte Exsudate mit weißlichen Einscheidungen der Venolen selbst. Die temporalen Gefäßbögen sowie Makula und Papille sind unauffällig. Im Glaskörper erkennt man als helle diskoide Überlagerungen eine Synchisis scintillans. Unter der FLADOP füllt sich das retinale Gefäßbett regelrecht. Auffallend im weiteren Verlauf ist das inhomogene Füllungsmuster der Aderhaut. Bei einem bestimmten intraokularen Druck zeigen die verschiedenen Aderhautsegmente völlig unterschiedliche Füllungsstadien (Abb. 50) . Während ein Segment temporal unten bereits eine diffuse Anfärbung der Choriokapillaris aufweist, beginnen sich in dem darüberliegenden Segment gerade die ersten großen Aderhautgefäße zu füllen. In der Detailvergrößerung (digitaler Zoom, Abb. 17 ) läßt sich beobachten, daß die entsprechenden Aderhautlobuli vollständig gefüllt sind, jedoch eine Ausbreitung des Fluoreszeins in das benachbarte Segment nicht stattfindet. Die peripapilläre Aderhaut zeigt dagegen die dazwischenliegende lobuläre Füllungsphase. In der Darstellung des Füllungsverlaufs als Aderhautprofil ist das verzögerte Segment als großflächige Einsenkung des Profils zu erkennen (Abb. 51) . Die Perfusionsdruckspanne der Aderhaut beträgt hier 42 mmHg. Gegenüber dem augengesunden Kontrollkollektiv (24,5 ± 5,4 mmHg) ist sie hochsignifikant verzögert (Irrtumswahrscheinlichkeit = 1%) und somit als pathologisch im Sinne einer sekundären Aderhautdurchblutungsstörung mit segmentalem Charakter zu werten. |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 50 C.K., männlich, 50 Jahre Morbus Eales (DFC-FLADOP, IOD = 78 mmHg) |
|
||||||||||||||||||||||||||||||||||||||||
|
Abb. 51 C.K., männlich, 50 Jahre Morbus Eales |
|
||||||||||||||||||||||||||||||||||||||||
|
3.8. Weitere Ergebnisse zur Methodik |
. | ||||||||||||||||||||||||||||||||||||||||
|
3.8.1. Einfluß des Druckverlaufes |
Wir haben
uns die Frage gestellt, wie die Qualität und der Informationsgehalt
der Angiogramme von der Dauer der Drucksenkungsphase beeinflußt wird.
Durch Austausch der Einlaßventile an unserem Hg-FLADOP-System können
wir die Geschwindigkeit des Druckausgleichs variieren. Wir haben innerhalb
des Patientenkollektivs 5 Gruppen gebildet, die bei unterschiedlicher Dauer
der Drucksenkungsphase untersucht wurden. Außerdem wurden die Angiogramme,
die wir mit Hilfe des OODG angefertigt haben, in die Beurteilung einbezogen.
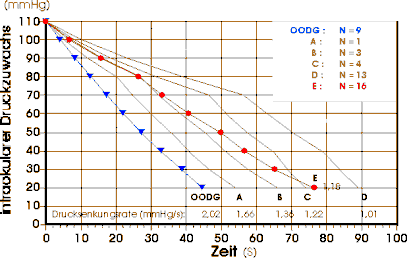
Die einzelnen Verläufe der Drucksenkungsphasen sind in
Abb. 52
wiedergegeben. Bei einem schnelleren Druckausgleich (Kurve A und OODG in Abb. 52) kann man einen sehr raschen Einstrom des Fluoreszeins in die retinalen Gefäße beobachten. Nach bereits 4-5 Pulsationsphänomenen sind die retinalen Arteriolen bis über den angiographischen Fundusausschnitt gefüllt. Auch die Anfärbung des choroidalen Gefäßbettes vollzieht sich zu rasch und ist somit oft schwer zu beurteilen. Vor allem für die Analyse der tieferliegenden Aderhautgefäße erweist es sich als sinnvoll, den intraokularen Druck so langsam wie möglich auszugleichen (Kurve C, D und E in Abb. 52). Je länger der Einstrom des Fluoreszeins in die Choriokapillaris und die dortige interstitielle Anreicherung verzögert wird, umso deutlicher stellen sich die Aderhautgefäße der Haller'schen und Sattler'schen Schicht dar. Ebenso können während der lobulären Füllungsphase die einzelnen Aderhautsegmente und die entsprechenden Wasserscheiden besser differenziert werden. Eine Verlängerung der Drucksenkungsphase ist außerdem erwünscht, da die zu beurteilenden angiographischen Phänomene in Abhängigkeit vom momentan herrschenden Augeninnendruck beschrieben werden sollen. Bei schnellerem Druckausgleich (OODG, Kurve A in Abb. 52) erkennt man anhand des raschen Voranschreitens der Farbstofffront in den verschiedenen Gefäßabschnitten, daß die Verteilung des Fluoreszeins nicht ausschließlich durch den intraokularen Druck, sondern auch durch das Blutflußvolumen bestimmt wird. Andererseits sollte die Dauer der Drucksenkungsphase nicht unnötig ausgedehnt werden, um keine vermeidbaren Belastungen des Auges zu verursachen. Auch wird die Saugnapfokulopression von den Patienten nicht unbegrenzt toleriert. In mehreren Eigenversuchen (3 FLADOP und 3 Saugnapfokulopressionen ohne Angiographie) konnten wir feststellen, daß eine Drucksenkungsphase über 100 Sekunden als unangenehm empfunden wird. Ist dagegen die Drucksenkungsphase nach weniger als 80 Sekunden abgeschlossen, so wird die Saugnapfokulopression von den Probanden als kaum störend beschrieben. Wir finden eine Drucksenkungsrate von 1,18 mmHg/s (Kurve E in Abb 52) als besten Kompromiss zwischen geringster Belastung des Patienten einerseits und Optimierung der angiographischen Darstellung andererseits. Demgegenüber gleicht der Okulo-Oszillo-Graph die intraokulare Druckerhöhung fast zweimal so schnell aus (2,02 mmHg/s, Kurve OODG in Abb. 52). |
||||||||||||||||||||||||||||||||||||||||
|
Abb. 52 Verlauf des Druckausgleichs mit OODG und Hg-FLADOP-System |
|
||||||||||||||||||||||||||||||||||||||||
|
3.8.2. Komplikationen der Saugnapfokulopression
|
Zur FLADOP
werden mittels Saugnapfokulopression suprasystolische Augeninnendrucke erzeugt.
Der maximale intraokulare Druckzuwachs liegt entsprechend dem systemischen
Blutdruck zwischen 90 und 110 mmHg. Die negative Druckdifferenz im Saugnapf
(Durchmesser 11 mm) beträgt dabei maximal ca. 580 mmHg.
Trotz dieser starken Saugkraft, die auf die episkleralen und konjunktivalen Gefäße einwirkt, wird die Saugnapfokulopression gut vertragen. Bei insgesamt 46 FLADOP's beobachteten wir keinerlei Nebenwirkungen der Saugnapfokulopression wie zum Beispiel subkonjunktivale Blutungen. Auch die ophthalmoskopischen Nachkontrollen der korrespondierenden Netzhautareale lassen keine schädigenden Folgen der Saugnapfokulopression erkennen. Eine spätere Befragung der Patienten ergab, daß die lokale Bindhauthyperämie nach spätestens 2-3 Stunden abgeklungen ist. Bei 5 Patienten kam es während der Okulopression zu einer passageren Trübung der Hornhaut. Der Funduseinblick war somit nur schemenhaft möglich. Nach Abbruch der Untersuchung klarte die Hornhaut binnen weniger Minuten ohne weitere Folgen wieder auf. Die Hornhautdekompensation kam nur bei Patienten jenseits des 60. Lebensjahres vor. |
||||||||||||||||||||||||||||||||||||||||
|
3.8.3. Vorteile des Hg-FLADOP-Systems |
Aufgrund
der direkten Anwendung physikalischer Basisprinzipien entfällt jegliche
Notwendigkeit der Eichung unseres Systems. Im Gegenschluß läßt
sich sogar feststellen, daß das Hg-FLADOP-System zur Eichung des OODG
nach Ulrich oder anderer negativen Druck erzeugender Apparate geeignet ist.
Wir führten eine Eichung des OODG-Gerätes durch. Bei der Eichung ist zu beachten, daß die elektro-mechanischen Teile des OODG den gleichen Bedingungen ausgesetzt sind, wie sie bei der praktischen Anwendung (Saugnapf an Bulbus festgesaugt) herrschen. Dazu ziehen wir an beiden Geräten die Saugnäpfe von den Schläuchen ab und schließen diese Schlauchenden luftdicht an einen Zwei-Wege-Hahn. Der Zwei-Wege-Hahn wird verschlossen. Nach Betätigen der Taste " Const." erzeugt man am OODG einen Unterdruck, welcher an der Digitalanzeige abgelesen werden kann. Der gleiche Druckwert wird nun am Hg-FLADOP eingestellt. Falls nun der durch den OODG angezeigte Wert dem tatsächlich erzeugten negativen Druck entsprechen würde, dürfte nach Öffnen des Zwei-Wege-Hahns keine Veränderung der Quecksilbersäule zu beobachten sein. Wir müssen feststellen, daß der vom OODG angezeigte Druckwert in Wirklichkeit nicht erreicht wird. Dies gilt vorallem bei hohen negativen Druckdifferenzen. So liegt zum Beispiel bei einer Anzeige von 550 mmHg der tatsächliche negative Druck im Saugnapf bei nur 510 mmHg, d.h. die intraokulare Drucksteigerung ist um 7 mmHg geringer als eigentlich erwartet. Angesichts der Feststellung von Stodtmeister et al. (1989), daß die Beziehung zwischen negativem Druck im Saugnapf und resultierender intraokularer Druckerhöhung einer gewissen Streuung unterliegt, sollten solche zusätzlichen gerätebedingte Abweichungen vermieden werden. Aus bereits oben genannten Gründen können solche Ungenauigkeiten bei unserem Hg-FLADOP-System mit Sicherheit ausgeschlossen werden. Da das Innere des Saugnapfes mit den Raum über der Quecksilbersäule direkt kommuniziert, ist auch bei noch so schnellen Druckveränderungen eine Übereinstimmung des angezeigten mit dem tätsächlichen negativen Druck gewährleistet. Jedes System, das Drucke erzeugt bzw. diese verändern kann, unterliegt einer bestimmten Trägheit. Bei der Planung des Hg-FLADOP-Systems versuchten wir, diese Trägheit zu minimieren. Da aufwendige Pump- und Steuermechanismen entfallen, ist es z.B. möglich nach Fixierung des Saugnapfes am Bulbus innerhalb 0,3 s die negative Druckdifferenz auf 500 mmHg zu steigern, d.h. eine intraokulare Druckerhöhung um 100 mmHg kann binnen 0,3 Sekunden realisiert werden. Die internen Vakuumpumpen des OODG benötigen für den gleichen Vorgang mehr als 4 Sekunden. Somit kann durch das Hg-FLADOP-System die Untersuchungsdauer bei gleicher Drucksenkungsphase verkürzt werden. Im Gegensatz zum OODG ermöglicht das Hg-FLADOP-System eine freie Variation des Verlaufs der Drucksenkungsphase während der FLADOP. Somit konnte mit unserem Gerät zum erstenmal die Frage beantwortet werden, bei welchem Druckverlauf eine optimale Darstellung der retinalen und choroidalen Gefäßabschnitte erreicht werden kann. |
|
|
|